Прежде всего придётся разобраться с терминологией, поскольку не только многие считают термины «нашатырный спирт» и «аммиак» синонимами, но и попутно относят сюда же слово «нашатырь», считая его эдаким «сокращённым вариантом» — что абсолютно неверно. Итак, аммиак — это собственное название лишь одного из множества возможных соединений азота с водородом, в котором в каждой молекуле на один атом азота приходится три атома водорода.
При обычных условиях (то есть комнатной температуре и нормальном давлении) это соединение является газом со специфическим очень резким запахом. Под термином же «нашатырный спирт» принято понимать слабенький водный раствор (не более 10%!) гидрата аммиака в воде, преимущественно для медицинских применений. Бытующее неправильное сокращение этого названия до «нашатырь» ошибочно — ибо под последним скрывается твёрдая соль, образованная из аммиака и соляной кислоты, имеющая как чисто медицинское, так и различные бытовые применения (например, в качестве пищевой добавки E510 или флюса при пайке железных изделий).
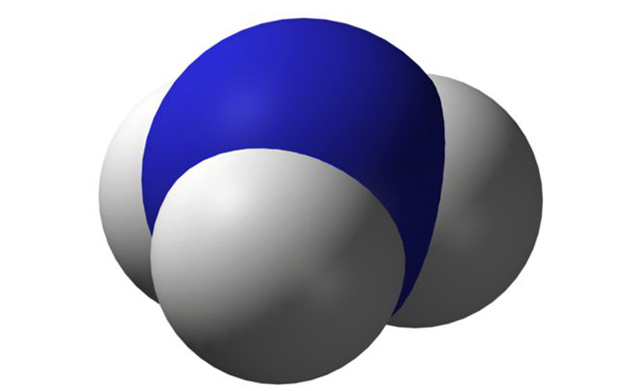
Молекула Аммиака
Откуда вообще взялось название «нашатырный спирт»?
Единого мнения на этот счёт нет, однако имеющая хождение теория такова: у алхимиков, впервые «добравшихся» до этого вещества, было своё представление об околохимических сущностях, основанное на «духах» и «квинтэссенциях». Например, «дух вина» (spiritus vini) — это винный (этиловый) спирт, всем известная летучая и пахучая субстанция, придающая вину известные свойства. Нашатырный спирт тоже весьма летуч и пахуч, хоть и весьма своеобразно — и поэтому он и был немедля зачислен в «отряд духов».
Неспециалисту трудно уследить, как в бытовых условиях аммиак может «обращаться» в нашатырный спирт и обратно, поскольку в окружающем нас воздухе хотя бы в следовых количествах всегда имеется влага (вода), а аммиак к ней, мягко говоря, «очень-очень неравнодушен»: при комнатных условиях один объём воды может растворить порядка 700 (именно так — семисот!) эквивалентных объёмов газообразного аммиака, а при нуле градусов эта цифра вообще возрастает до ~1200 объёмов!
Так в чём же заключены наиболее важные отличия между ними?
Выше уже упоминалось, что нашатырный спирт — лишь слабый раствор гидрата аммония в воде, для медицинских применений. Почему это так важно?
Во-первых, аммиак может производиться и продаваться как продукт в виде концентрированных водных растворов (от 25% и выше) — и такие растворы в быту просто чрезвычайно опасны! Дело в том, что концентрированные растворы аммиака всегда содержат над своей поверхностью значительное количество этого газа, который в 1.7 раза легче воздуха.
Во-вторых, концентрированные водные растворы аммиака являются едким веществом, запросто могущим повредить не только слизистые оболочки человека, но и саму кожу (не говоря уже об общем отравлении организма посредством проникновения через неё — ведь аммиак при длительном контакте достаточно легко «просочится» и через кожу, и через тонкую бытовую резину).
В-третьих, даже простое разбавление концентрированного раствора до «спиртовых» кондиций с последующим применением потенциально чревато негативными последствиями, так как концентрированные растворы обычно являются «техническими» и могут содержать не нормируемое количество опасных для человека примесей (вообще, ранее в промышленности такие растворы побочно получали при коксовании углей — а ведь в этом процессе попутно выделяется масса тяжёлых канцерогенов!)
В-четвёртых, с чисто химической точки зрения это разные вещества: аммиак является газом с химической формулой NH3, а нашатырный спирт — водным раствором гидрата этого газа (в старых учебных пособиях это соединение обычно записывалось в виде NH4OH, в более новых часто используется сокращение вида NH3⋅H2O).