Прежде, чем отвечать на вопрос, поставленный в названии статьи, разберемся, что такое пар. Образы, возникающие у большинства людей при этом слове: кипящий чайник или кастрюля, парилка, горячий напиток и еще множество подобных картинок. Так или иначе, в наших представлениях присутствует жидкость и газообразная субстанция, поднимающаяся над ее поверхностью. Если вас попросят привести пример пара, вы сразу вспомните водяной пар, пары спирта, эфира, бензина, ацетона.

Существует еще одно слово для обозначения газообразных состояний – газ. Здесь мы обычно вспоминаем кислород, водород, азот и другие газы, не ассоциируя их с соответствующими жидкостями. При этом хорошо известно, что они существуют и в жидком состоянии. На первый взгляд различия заключаются в том, что пар соответствует естественным жидкостям, а газы надо сжижать специально. Однако это не совсем верно. Более того, образы, возникающие при слове пар – паром не являются. Чтобы дать более точный ответ, разберемся, как возникает пар.
Чем отличается пар от газа?
Агрегатное состояние вещества задается температурой, точнее соотношением между энергией, с которой взаимодействуют его молекулы и энергией их теплового хаотического движения. Приближенно, можно считать, что если энергия взаимодействия значительно больше – твердое состояние, если значительно больше энергия теплового движения — газообразное, если энергии сравнимы – жидкое.
Молекула газа
Получается, чтобы молекула могла оторваться от жидкости и участвовать в образовании пара, величина тепловой энергии должна быть больше энергии взаимодействия. Как это может произойти? Средняя скорость теплового движения молекул равна определенному значению, зависящему от температуры. Однако индивидуальные скорости молекул различны: большая их часть обладает скоростями близкими к среднему значению, но некоторая часть имеет скорости больше средней, некоторая — меньше.
Более быстрые молекулы могут иметь тепловую энергию большую, чем энергия взаимодействия, а значит, попав на поверхность жидкости, способны оторваться от нее, образуя пар. Такой способ парообразования называется испарением. Из-за того же распределения скоростей существует и противоположный процесс — конденсация: молекулы из пара переходят в жидкость. Кстати образы, которые обычно возникают при слове пар, это не пар, а результат противоположного процесса — конденсации. Пар увидеть нельзя.

Испарение
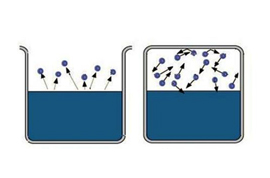
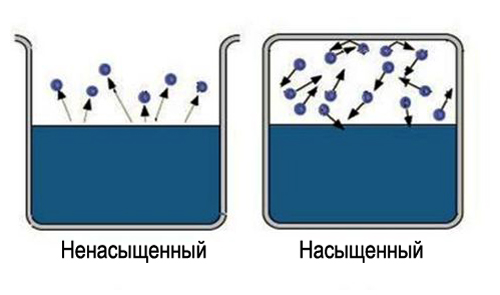
Что такое пар насыщенный и ненасыщенный
Само слово «насыщенный» несет определенную информацию, трудно насытить большую область пространства. Значит, чтобы получить насыщенный пар, надо ограничить пространство, в котором находится жидкость. Температура при этом должна быть меньше критической для данного вещества. Теперь испарившиеся молекулы остаются в пространстве, где находится жидкость. Сначала большинство переходов молекул будет происходить из жидкости, при этом плотность пара будет повышаться. Это в свою очередь вызовет большее число обратных переходов молекул в жидкость, что увеличит скорость процесса конденсации.
Наконец, устанавливается состояние, для которого среднее число молекул, переходящих из одной фазы в другую будет равным. Такое состояние называется динамическое равновесие. Для этого состояния характерно одинаковое изменение величины и направления скоростей испарения и конденсации. Это состояние соответствует насыщенному пару. Если состояние динамического равновесия не достигнуто, это соответствует ненасыщенному пару.
Начинают изучение какого-то объекта, всегда с самой простой его модели. В молекулярно-кинетической теории это — идеальный газ. Основные упрощения здесь — пренебрежение собственным объемом молекул и энергией их взаимодействия. Оказывается, подобная модель вполне удовлетворительно описывает ненасыщенный пар. Причем чем менее он насыщен, тем правомернее ее применение. Идеальный газ — это газ, он не может стать ни паром, ни жидкостью. Следовательно, для насыщенного пара подобная модель не является адекватной.
Основные отличия насыщенного пара от ненасыщенного
- Насыщенный означает, что данный объект имеет самое большое из возможных значений некоторых параметров. Для пара — это плотность и давление. Эти параметры для ненасыщенного пара имеют меньшие значения. Чем дальше пар от насыщения, тем меньше эти величины. Одно уточнение: температура сравнения должна быть постоянной.
- Для ненасыщенного пара выполняется закон Бойля-Мариотта: если температура и масса газа постоянны, увеличение или уменьшение объема, вызывает уменьшение или увеличение давления во столько же раз, давление и объем — связаны обратно пропорциональной зависимостью. Из максимальности плотности и давления при постоянной температуре вытекает их независимость от объема насыщенного пара, получается, что для насыщенного пара давление и объем — не зависят друг от друга.
- Для ненасыщенного пара плотность не зависит от температуры, и если объем сохраняется, не меняется и значение плотности. Для насыщенного пара при сохранении объема плотность изменяется, если изменяется температура. Зависимость в данном случае прямая. Если увеличивается температура, увеличивается и плотность, если температура уменьшается, так же изменяется плотность.
- Если объем постоянен, ненасыщенный пар ведет себя в соответствии с законом Шарля: при увеличении температуры во столько же раз увеличивается и давление. Такая зависимость называется линейной. У насыщенного пара при увеличении температуры давление возрастает быстрее, чем у ненасыщенного пара. Зависимость имеет экспоненциальный характер.
Подводя итог, можно отметить значительные различия свойств сравниваемых объектов. Основное отличие в том, что пар, в состоянии насыщения, нельзя рассматривать в отрыве от его жидкости. Это двухкомпонентная система, к которой нельзя применять большинство газовых законов.