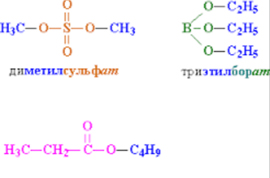
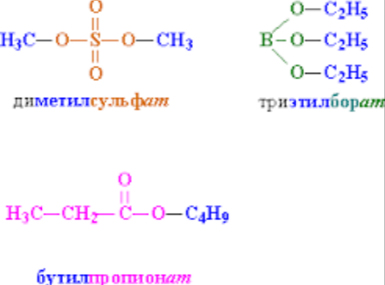
В органической химии существует два основных класса эфиров: простые и сложные. Это химические соединения, образующиеся при гидролизе (отщеплении молекулы воды). Простые эфиры (их еще называют этеры) получают при гидролизе соответствующих спиртов, а сложные эфиры (эстеры) – соответствующих спирта и кислоты.
Несмотря на похожее название, простые и сложные эфиры это два совершенно разных класса соединений. Их получают разными путями. Они имеют различные химические свойства. Различаются они и структурной формулой. Общими есть лишь некоторые физические свойства самых известных их представителей.
Физические свойства этеров и эстеров
Простые эфиры — малорастворимые в воде, легкокипящие жидкости, легко воспламеняются. При комнатной температуре, простые эфиры — приятно пахнущие бесцветные жидкости.
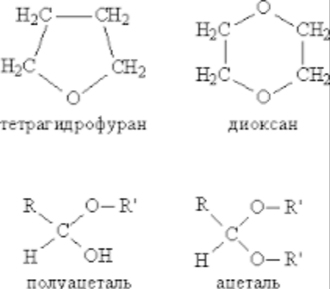
Сложные эфиры, имеющие малую молекулярную массу — легко испаряющиеся бесцветные жидкости, приятно пахнут, часто фруктами или цветами. С возрастанием карбоновой цепи ацилгруппы и спиртового остатков, их свойства становятся другими. Такие эфиры твердые вещества. Их точка плавления зависит от длинны углеродных радикалов и структуры молекулы.
Структура простых и сложных эфиров
Оба соединения имеют простую эфирную связь (-О-), но в сложных эфирах она входит в состав более сложной функциональной группы (-COO), в которой первый атом кислорода связан с атомом карбона одинарной связью (-О-), а второй двойной (=О).
Схематически можно изобразить так:
- Простой эфир: R–O–R1
- Сложный эфир: R—COO—R1
В зависимости от радикалов в R и R1, простые эфиры делят на:
- Симметричные эфиры – такие у которых алкильные радикалы идентичны, например, дипропиловыйэфир, диэтиловый эфир, дибутиловый эфир и т.п.
- Асимметричные эфиры или смешанные – с разными радикалами, например, этилпропиловый эфир,метилфениловый эфир, бутилизопропиловый и т.д.
Сложные эфиры подразделяют на:
- Сложные эфиры спирта и минеральной кислоты: сульфатной (-SO3H), нитратной (-NO2) и др.
- Сложные эфиры спирта и карбоновой кислоты, например, С2Н5СО-, С5Н9СО-, СН3СО- и т. д.
Рассмотрим химические свойства эфиров. Простые эфиры имеют низкую реакционную способность, именно благодаря этому их часто применяют как растворители. Они реагируют только в экстремальных условиях, или с высокореакционными соединениями. В отличии от этеров, сложные эфиры более реакционноспособные. Они легко вступают в реакции гидролиза, омыления и др..
Простые эфиры
Реакция простых эфиров с галогеноводородами:
Большинство простых эфиров могут разлагаться под воздействием бромоводородной кислоти (HBr) с образованием алкилбромидов или при взаимодействии с иодоводородной кислотой (HI) с получениемалкилиодидов.
СН3—О—СН3 + НI = СН3—ОН + СН3I
СН3—ОН + НI = СН3I + Н2О
Образование оксониевых соединений:
Серная, иодная и др. сильные кислоты при взаимодействии с простыми эфирами, образуют оксониевые соединения – продукты соединения высшего порядка.
СН3—О—СН3 + HCl = (CH3)2О ∙ HCl
Взаимодействие простых эфиров с металлическим натрием:
При нагревании с основными металлами, например, металлическим натрием, простые эфиры расщепляются на алкоголяты и алкилнатрий.
СН3—О—СН3 + 2Na = СН3—ОNa + СН3—Na
Автоокисление простых эфиров:
В присутствии кислорода, простые эфиры медленно автоокисляются с образованием гидроперекиси идиалкил пероксида. Автоокисление является спонтанным окислением соединения в воздухе.
С2Н5—О—С2Н5 + О2 = СН3—СН(ООН)—О—С2Н5
Сложные эфиры
Гидролиз сложных эфиров:
В кислой среде эстер гидролизует, образуя соответствующую кислоту и спирт.
СН3—СОО—С2Н5 = СН3—СООН + Н2О
Омыление сложных эфиров:
При повышенной температуре эстеры реагируют с водными растворами сильных оснований, таких как гидроксид натрия или калия, образуя соли карбоновых кислот. Соли жрных карбоновых кислот называют мылами. Побочным продуктом реакции омыления является спирт.
СН3—СОО—С2Н5 + NaОН = СН3—СООNa + С2Н5—ОН
Реакции переэстерефикации (обмена):
Сложные эфиры вступают в реакции обмена при действии спирта (алкоголиз), кислоты (ацидолиз), или при двойном обмене, при взаимодействии двух сложных эфиров.
СН3—СОО—С2Н5 + С3Н7—ОН = СН3—СОО—С3Н7 + С2Н5—ОН
СН3—СОО—С2Н5 + С3Н7—СООН = С3Н7—СОО—С2Н5 + СН3—СООН
СН3—СОО—С2Н5 + С3Н7—СОО—СН3 = СН3—СОО—СН3 + С3Н7—СОО—С2Н5
Реакции взаимодействия с аммиаком:
Сложные эфиры могут взаимодействовать с аммиаком (NН3) с образованием амида и спирта. По тому же принципу реагируют они и с аминами.
СН3—СОО—С2Н5 + NН3 = СН3—СО—NН2 + С2Н5—ОН
Реакции восстановления эстеров:
Эфиры могут быть восстановлены водородом (Н2) в присутствии хромита меди (Cu(CrO2)2).
СН3—СОО—С2Н5 + 2Н2 = СН3—СН2—ОН + С2Н5—ОН