Дисперсные растворы — это системы, в которой фаза представлена частицами размером от 1 нм до 10 мкм. Дисперсные системы распространены, используются в промышленности. К ним относят: аэрозоли (капли или твердые частицы взвешены в воздухе), эмульсии (капли жидкости растворены в другой по природе жидкости), коллоидные растворы — являются золями (двухфазные гетерогенные системы, размер частиц которых находится в промежутке между эмульсиями и истинными растворами, то есть в пределах от 1 до 100 нм. Дисперсные частицы могут находиться в разнообразном агрегатном состоянии. Ансамбль частиц является фазой, а их совокупность — дисперсная среда (жидкие, газообразные и твердые).
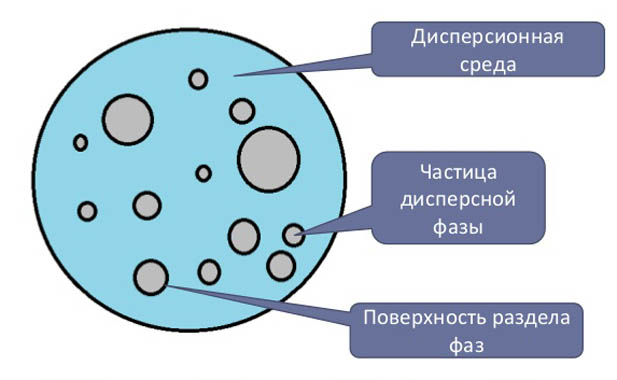
Состав дисперсной системы
Свойства и применение коллоидных растворов
В широком смысле, в сущности, коллоиды это все природные организмы и растения окружающей среды, преобладающую часть которых мы принимаем с пищей в коллоидном состоянии. К коллоидам также относят медикаменты, некоторые краски и даже строительные материалы (вяжущие растворы цемент и бетон, лакокрасочные и керамические материалы, горючие материалы, искусственные волокна, пластмассы).
Кинетические свойства гетерогенных дисперсных систем. Движение обусловлено различием размера частиц. Тонкая суспензия способна к броуновскому беспорядочному движению. К примеру, жир, добавленный в воду или молоко разбавленный водой. Движение частиц коллоидного раствора является термодинамические энергоемким.

Другим кинетическим свойством растворов является диффузия: процесс движения частиц вследствие различия их концентраций. Но твердые грубодисперсные частицы не участвуют в хаотичном движении, однако основная причина их движения — это разделение плотности фаз в дисперсной среде. Поэтому если плотность больше, то частицы постепенно оседают под действием сил тяжести — процесс седиментацией. Весьма распространенный процесс, используемый в молекулярной химии белков, нуклеиновых молекул и даже бактерий. Осмотическое давление коллоидов очень мало, так как коллоид обладает большой массой.

Оптические свойства раствора обусловлены способностью рассеивать свет, то есть наличие явления опалесценции (из-за оптической неоднородности). Наблюдается, если пропускать пучок света через кюветку, поставив перед собой линзу, тогда со стороны виден эффект (конус Тиндаля). Обусловлено это зависимостью размером частицы раствора и длины светового пучка.
Истинные растворы и их свойства
Истинные растворы — это прозрачные, однородные растворы с прочной дисперсной фазой, частицы размером меньше чем один нанометр, поэтому граница разделения фазы в растворе исчезает. Истинные растворы подразделяются на ионные, если дисперсная фаза состоит из гидратированных ионов (раствор натрий хлора, либо молекулярные (раствор глюкозы). Для человека незаменимую часть жизни играет вода, потому как в ней растворены все ионы организма, благодаря ней в организме происходят все обменные процессы между клетками.

Отличия между коллоидами и истинными растворами
Во-первых, истинные растворы прозрачные и гомогенные, частицы в дисперсной фазе меньше нанометра. Для них не характерна дифракция или опалесценция, нет конуса Тиндаля, то есть частицы настолько малы, что даже не видимы в ультрамикроскоп. При фильтрации коллоидные растворы через бумажные фильтры не проходят, а истинные фильтруются с легкостью, что показывает отличия между размером частиц дисперсной фазы. Истинные растворы проходят через клеточные мембраны. Термодинамичны и не устойчивы, расслаиваются, что характерно для коллоидных р-ров, а истинные — не расслаиваются.
Истинные растворы могу образовываться самопроизвольно, без затраты дополнительной энергии, а коллоидный раствор наоборот, то есть энергетический баланс для них не устойчив. Силы преобразования между фазой и средой для истинных растворов довольно велики, поэтому им не требуется стабилизатор. Механические свойства растворов отличны друг от друга. Истинные растворы более прочны, так как дисперсная фаза неподвижна, образует структуру внутри которой заключена среда (к примеру, костная ткань). Коллоидный раствор свободнодисперсные, обладает текучестью, поэтому концентрация фазы и среды равномерно распределены (пыль, дым либо туман).