Говоря строго, вынесенный в заголовок вопрос один из самых часто задаваемых — и неправильный по своей сути. В чём же дело?
Немного истории, теории и интересных фактов
Прототип свинцово-кислотного аккумулятора был изобретён ещё 1859-ом году — и предложенная схема оказалась весьма удачной (за подробностями его работы отошлём интересующихся к учебнику химии или Википедии). Как видно из самого названия, в таком аккумуляторе используются свинец (и некоторые его соединения) и раствор кислоты в качестве заполняющего электролита — и кислота является проблемой.
Применяемая здесь серная кислота (а заменить её на другую в этом типе аккумуляторов нельзя) — весьма неприятное, крайне едкое соединение. Напомним один школьный опыт: в стакан с насыпанным сахарным песком льют серную кислоту высокой концентрации — и спустя некоторое время из стакана вылезает наружу чёрная «змея» из пористого угля (кислота отняла воду от смеси углеводов, обратив их в уголь). Разумеется, в аккумуляторе используется разбавленная кислота, на такое не способная — но тут обнаруживается ещё одно неприятное свойство серной кислоты: при обычных условиях эта кислота нелетуча!
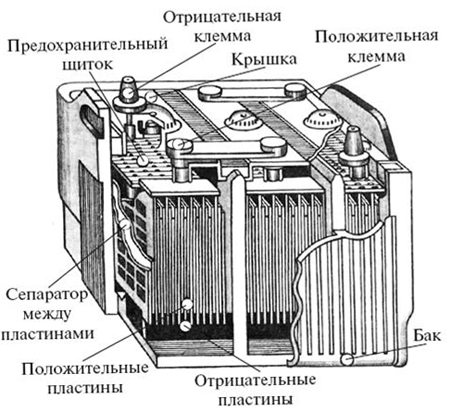
Из этого следует, что капелька разбавленной кислоты, предоставленная самой себе, через некоторое время «самоконцентрируется» из-за испарения воды — и вуаля, вот вам новая дырка на джинсах или забытой рядом с аккумулятором книжке! Откуда массово берутся микрокапли кислоты?

Кислотный аккумулятор
Да будет гель!
Помимо «разбрызгивания кислоты» у обычного свинцово-кислотного аккумулятора есть и другие недостатки: изменение уровня электролита, за которым необходимо следить, проблемы протечек при образовании трещин в корпусе и так далее. Можно ли этого избежать? Напрашивающийся ответ — чем-нибудь загустить электролит, обратив его в гель. Теперь становится понятна ошибочность постановки вопроса в заголовке: в обоих случаях вы имеете дело со свинцово-кислотным (или просто «кислотным» — так обычно сокращают название на практике) аккумулятором, но в «гелевых» у используемого электролита свойства жидкости «подавлены» тем или иным образом сформированным гелем.

Гелевый аккумулятор
Так чем же они действительно отличаются?
Применение геля позволяет превратить аккумулятор в необслуживаемый (герметичный) — что сразу снимает вышеописанные неудобства. Помимо этого, такой аккумулятор практически не подвержен осыпанию активной массы с пластин, имеет меньший саморазряд и за счёт этого — увеличенный срок службы. Однако не зря сказано «наши недостатки являются продолжением наших достоинств» — что абсолютно верно и для этого случая.

Гель несколько увеличивает внутреннее сопротивление аккумулятора (снижает максимально возможный, пиковый ток — что делает его весьма чувствительным к короткому замыканию), а перезаряд (перенапряжение при заряде) сказываются на нём как правило фатально. «Не любит» гелевый электролит и низких температур — при этом общий заряд и прочие показатели могут легко упасть в два-четыре раза, а из-за «врождённой» герметичности такой аккумулятор неремонтопригоден (его уже не спасут «шаманские процедуры» со сменой электролита, восстановление асимметричным током и тому подобные «народные» приёмы, весьма часто и довольно успешно используемые при «реанимации» обычных кислотных аккумуляторов).
В любом случае, у автолюбителей возможность выбора есть — а вот при домашнем (внутриквартирном) использовании альтернативы аккумулятору с гелевым электролитом практически нет: батареи для компьютерных бесперебойных блоков питания (UPS) изготавливаются только по этой технологии.