Атомы и ионы – микроскопические частицы, которые состоят из ядра и электронов, вращающихся вокруг него по орбиталям. Основное, но не единственное, отличие между этими частицами состоит в том, что ион несет определенный заряд, а атом – нет.
Общие сведения об атомах и ионах
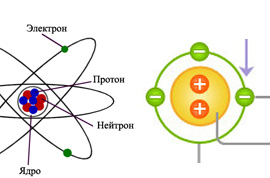
Атом – наименьшая частица вещества, обладающая всеми его свойствами. Радиус атома измеряется в пикометрах (метра). Атом – электронейтральная, то есть не несущая заряда структура, состоящая из ядра и вращающихся вокруг него электронов. Ядро атома состоит из протонов и нейтронов, которые также называются субатомными частицами. Протон несет положительный заряд, по модулю равный заряду электрона. Нейтроны не имеют заряда. Количество электронов в атоме соответствует числу протонов в ядре, что делает атом в целом электронейтральным.
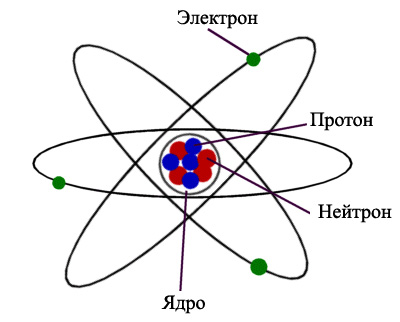
Атом
Ион – неэлементарная частица, несущая положительный или отрицательный заряд. Ион получается в процессе отрыва или присоединения электрона к атому или группе атомов. Ион с отрицательным зарядом (атом с избытком электронов) называется анионом, а ион, несущий положительный заряд, (атом с недостатком электронов) – катионом.
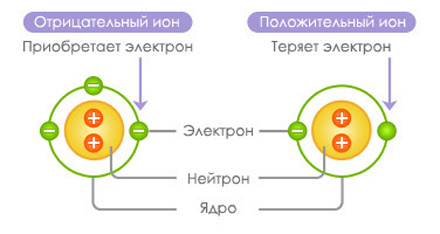
Ионы
Как происходит образование ионов
Ион образуется из атома в процессе, называемом ионизацией. Катион образуется, когда электрон в атоме получает энергию ионизации, дающую ему возможность преодолеть потенциальный барьер, и удалится от атома, преодолев силы электростатического притяжения. Процесс образования аниона происходит с выделением энергии, когда атом получает дополнительный электрон.
Ионизация может наступить из-за повышения температуры, воздействия электрического поля, рентгеновского излучения или освещения.
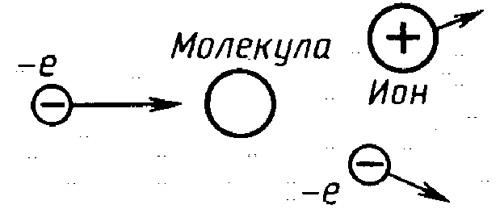
Ионизация газов
Все щелочные металлы (рубий, натрий, калий, литий, цезий, франций) являются хорошими восстановителями, то есть легко отдают электроны другим атомам, превращаясь в положительно заряженные ионы. Происходит это за счет невысокой энергии ионизации – до 5 эВ. Франций — самый сильный восстановитель. Атомы этого элемента отдают электроны легче, чем другие, за счет очень низкой энергии ионизации. Щелочные металлы имеют всего один валентный электрон, и его легче отдать, чем присоединить семь электронов для завершения энергетического уровня. Щелочные металлы могут превращаться в положительно заряженные ионы просто под воздействием освещения.
Аналогичным свойством обладает водород. Его атом имеет единственный электрон и легко отдает его, образуя катион.
Галогены – фтор, бром, йод, хлор и астат (элементы, находящиеся в основной подгруппе 7-ой группы таблицы Менделеева) обладают высокой электроотрицательностью – свойством смещать к себе общие пары электронов в соединении. Они легко образуют анионы, поскольку на внешнем уровне у них уже 7 электронов, и недостает всего одного для завершения уровня. Бром, хлор, йод и астат могут образовывать как отрицательные, так и положительные ионы при контакте с более электроотрицательными элементами. Фтор никогда не образует положительных ионов, так как является элементом с самой высокой электроотрицательностью и имеет высокую энергию ионизации.
Что же общего у атома и иона?
Атом и ион одного и того же элемента имеют в ядре одинаковое количество протонов и нейтронов.
Ион обозначается тем же символом, что и соответствующий химический элемент в периодической таблице, только справа указывается значение заряда.
Отличия между атомом и ионом
Основное отличие между атомом и ионом в том, что ион – заряженная частица, а атом – не заряженная.
Также атом и ион одного и того же элемента отличаются по массе, за счет разницы в количестве электронов. Катион имеет меньшую массу, чем атом того же элемента, а анион, соответственно, большую. Разница между массой атома и массой иона кратна массе электрона.
Ионы, в отличии от атомов, не обладают свойствами простого вещества. Примером этого могут служить кристаллы йода, которые имеют темно-синий цвет, в газообразном состоянии он фиолетовый, а его ионы бесцветны. Ионы йода не дают цветной реакции с крахмалом и не ядовиты, в отличии от кристаллов.
Аналогичный пример – медь. Этот металл имеет золотисто-красный цвет, а его ионы – зелено-голубые.
Калий – серебристый металл, атомы которого активно реагирую с водой, в то время как ионы этого вещества не обладают таким свойством. То же самое различие характерно для свойств атомов и ионов натрия.
Катион водорода в реакции с аммиаком формирует ион аммония. Для молекулы водорода такая реакция не характерна.
Ионы имеют завершенный внешний энергетический уровень – на нем 8 электронов. Никакие атомы, кроме инертных газов, не обладают этим свойством.